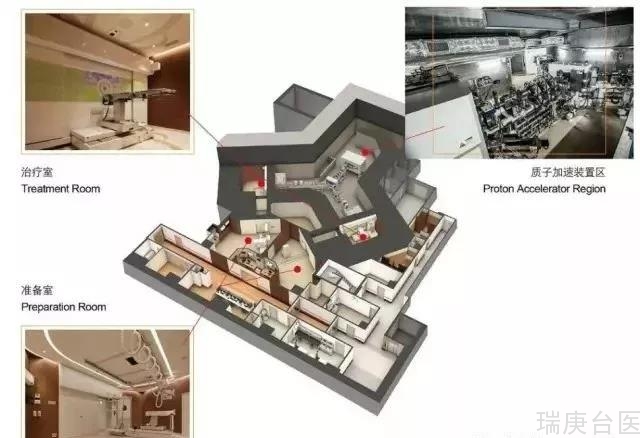
血液和正常组织中的硼10浓度与肿瘤组织中的硼10浓度相关。因此,在肿瘤组织中B的浓度可以通过测量血液中估计的硼10NCT期间B的浓度。但是,这种方法会导致估计误差。当前,存在三种类型的估计方法:
航迹技术;
电感耦合等离子体原子发射光谱法;
瞬发伽玛中子活化分析。
轨道雕刻技术高度敏感。但是,它不能用于实时测量。迄今为止,ICP‐AES是常用的方法。尽管处理时间短,但是ICP-AES的采样过程却很复杂。PGNAA准确,快速且无需样品处理,已在中国成功应用。氟-对-硼烷-苯丙氨酸正电子发射断层显像也已用于估算BNCT前肿瘤组织中硼的累积剂量,并已用于治疗多种癌症,例如转移性黑色素瘤和复发性口腔癌。
尽管18F-BPAPET在许多类型的癌症中均有效,但在炎症部位使用半定量评估其硼含量的特异性还不够好,其准确性仍存在一些局限性。因此,如何使其更准确地用于肿瘤的治疗尚待进一步研究。进入肿瘤细胞的硼10的数量和位置随肿瘤等级和生化特性而变化。为了使BNCT成为放射治疗更有效的技术,有必要获取更准确,实时的约10个数据来自不同肿瘤阶段的患者的B浓度。这样,可以准确地设定每个靶的中子照射的动态剂量分布,并且需要普遍适用于各种癌症,从而提高治疗效果。此外,磁共振成像与正电子发射断层扫描结合可能成为BNCT的未来方向之一。以下是BNCT对中子源的要求。首先是中子通量。第二点是必须在中子目标点产生的中子通量。第三个是中子能量,该能量应足够高以穿透肿瘤。令人满意的中子源仅由核裂变反应堆产生,这不仅成本高昂,而且还需要考虑操作和安全问题。加速器产生的中子束很难满足通量要求。此外,中子束的污染包括快中子和伽马射线污染也不能忽视。
高强度的中子源保证了高效的处理。核反应堆中子源用于BNCT已有很长时间了,因为高强度中子束仅由反应堆提供。但是,许多反应堆已经关闭。即使在中国,也只为BNCT建造了一个反应堆。另一方面,基于加速器的中子源在中子应用领域变得越来越流行。为了将基于医院的BNCT确立为一种常规治疗方法,必须在全球范围内开发紧凑的基于加速器的中子源。

 微信扫码
微信扫码
 意见反馈
意见反馈
 热线电话
热线电话

 ivy-客服
ivy-客服